Grensen for evolusjon
 I boka 'The Edge of Evolution' (2007) bedømmer M. Behe massive empiriske data, knyttet til tre viktige medisinske mikroorganismer (AIDS-virus, malaria-viruset og E-coli bakterien). Disse mikroorganismene er kjent for å være meget muterbare og gjennomgå massive seleksjons-sykluser. De blir referert til som 'kraftfulle eksempler på evolusjonære systemer'. Behe viser at mens disse organismene raskt tilpasser seg nye eksterne omgivelser, så frambringer de ingen indre funksjonelle endringer. Selv innen disse 'ideelle evolusjonære systemene', så representerer type endring bare 'fine-tuning', ikke sanne nyskapninger. Selv om forskere har fulgt disse organismene gjennom et enormt antall reproduktive sykluser, mange flere enn det høyere organismer har gjennomlevd på jorda, så har alle observerte endringer bare vært midlertidige virkemidler. Behe viser klart at det primære aksiomet ikke kan skape ikke-reduserbar kompleksitet, selv på enkleste nivå.
I boka 'The Edge of Evolution' (2007) bedømmer M. Behe massive empiriske data, knyttet til tre viktige medisinske mikroorganismer (AIDS-virus, malaria-viruset og E-coli bakterien). Disse mikroorganismene er kjent for å være meget muterbare og gjennomgå massive seleksjons-sykluser. De blir referert til som 'kraftfulle eksempler på evolusjonære systemer'. Behe viser at mens disse organismene raskt tilpasser seg nye eksterne omgivelser, så frambringer de ingen indre funksjonelle endringer. Selv innen disse 'ideelle evolusjonære systemene', så representerer type endring bare 'fine-tuning', ikke sanne nyskapninger. Selv om forskere har fulgt disse organismene gjennom et enormt antall reproduktive sykluser, mange flere enn det høyere organismer har gjennomlevd på jorda, så har alle observerte endringer bare vært midlertidige virkemidler. Behe viser klart at det primære aksiomet ikke kan skape ikke-reduserbar kompleksitet, selv på enkleste nivå.
En god tilpasning er problematisk å finne
 I boka Darwins Black Box forklarte Michael Behe hvordan design kan forståes i forbindelse med arrangering av deler. Det kan også oppdages i forbindelse med tilpasning av komplekse deler, selv om grunnen for tilpasningen er utydelig. Om en f.eks. går gjennom en skrapdynge, hvor alle slags komplekse deler ligger rundt omkring. Selv om skrapdynga var fylt av mange tilvirkede deler, var det ikke grunn til å tro at de hadde noe med hverandre å gjøre. Men anta at du så en kompakt delehaug, og da du plukket opp en del -så fulgte resten av delene med den. Selv om en ikke visste funksjonen til den sammensatte delen, så ville en være ganske sikker at den hadde blitt satt sammen med hensikt, fordi de passet spesifikt sammen.
I boka Darwins Black Box forklarte Michael Behe hvordan design kan forståes i forbindelse med arrangering av deler. Det kan også oppdages i forbindelse med tilpasning av komplekse deler, selv om grunnen for tilpasningen er utydelig. Om en f.eks. går gjennom en skrapdynge, hvor alle slags komplekse deler ligger rundt omkring. Selv om skrapdynga var fylt av mange tilvirkede deler, var det ikke grunn til å tro at de hadde noe med hverandre å gjøre. Men anta at du så en kompakt delehaug, og da du plukket opp en del -så fulgte resten av delene med den. Selv om en ikke visste funksjonen til den sammensatte delen, så ville en være ganske sikker at den hadde blitt satt sammen med hensikt, fordi de passet spesifikt sammen.
For å være sikker på at deler er designet til å passe sammen, så må delene være relativt komplekse og må passe hverandre temmelig nøyaktig. Om formen på delene er relativt enkle, eller om sammensetningen er temmelig løs, så kan komplementariteten deres bare være tilfeldigheter. Desto mer sammensatt f.eks. en emballasje er, desto sikrere kan en slutte til hensiktsfull design. En må være forsiktig når en slik skal slutte hvorvidt to ukjente deler ble designet for å passe sammen. Det kan avhenge av hvor mange deler som finnes. Om et varehus inneholdt millioner av små eksplisitte plastikk-former, så ville det ikke være for overraskende å finne en som passet relativt greit innenfor f.eks. en hjerte-formet mal. Desto flere biter, dess mer sannsynlig å finne noen som passer. Dessto mer kompleks form, desto mindre sannsynlig.
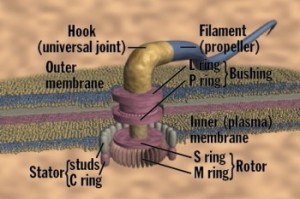
Bilde 2. Bakterie-flagell har dusinvis av samvirkende protein-deler
Protein-former
Proteiner har komplekse former og proteiner må passe spesifikt med andre proteiner for å utforme det molekylære maskineriet i cellen. Selv om en tidligere mente de fleste proteiner handlet hver for seg (individuelt), så har forskning i senere tiår oppdaget at de fleste proteiner i cellen faktisk virker sammen som et team på et halvt dusin eller flere. Fhv. president i National Academy of Sciences (NAS), Bruce Alberts, kommenterte: " Vi kan gå og vi kan snakke fordi kjemien som gjør livet mulig, er mye mer omhyggelig utarbeidet og sofistikert enn noe vi studenter noensinne har tatt i betraktning. I stedet for celler som domineres av tilfeldig kolliderende individuelle protein-molekyler, så vet vi nå at nesten hver hovedprosess i cellen utføres av sammensetninger av 10 eller flere protein-molekyler. Og som de utøver sine biologiske funksjoner, samvirker hver av disse protein-sammensetningene med flere store protein-komplekser. Faktisk kan hele cellen bli sett som en fabrikk som inneholder et utarbeidet nettverk av samvirkende samlebånd, der hver av dem er sammensatt av ett sett av store protein-motorer. (1)
Det som skiller disse motorene fra øvrige i vår hverdag, er at disse motorene må sette seg selv sammen. Motorer i fabrikker settes sammen av mennesker eller roboter, ut fra deres komplementære deler. Protein-deler i cellens maskiner, må ikke bare være tilpasset deres partners, men de må drive det mye lengre og sette seg selv sammen. Som en utgave av Nature uttrykte det: "Cellens makromolekylære maskiner inneholder dusinvis, ja endog hundrevis av komponenter. Men disse cellens maskiner setter seg spontant sammen ut fra deres protein og nukleotid -komponenter."
For å utføre en slik bedrift, må proteiner velge sine korrekte partnere å binde seg til, ut fra de mange tusen av andre proteiner i cellen. Et protein befinner seg vanligvis i en trengsel av mange potensielle partnere å knytte seg til. De fleste proteiner er meget spesifikke i sitt valg av partner, selv om noen har flere konkurrerende partnere å knytte seg til på sammenfallende eller overlappende grenseflater. (3)
For at to proteiner skal knytte seg til hverandre, er minimumskravet at proteinene må henge spesifikt til sin partner i rett posisjonering. Som vist i bildet til høyre, så må ikke bare formen på de to proteinene passe, men kjemiske egenskaper på overflaten må også være komplementære. Vi skal se litt på hvordan proteiner velger en partner å knytte seg til, og betrakte den store hindringen som utvikling av proteinsammensetninger utgjør for teorien om tilfeldige mutasjoner. Vi skal se at selv om noen sammensetninger er tilfeldige, så oppsto den store majoriteten av funksjonelle protein-sammensetninger ikke-tilfeldig. Og det innebærer at ikke-tilfeldighet strekker seg dypt ned i cellen.
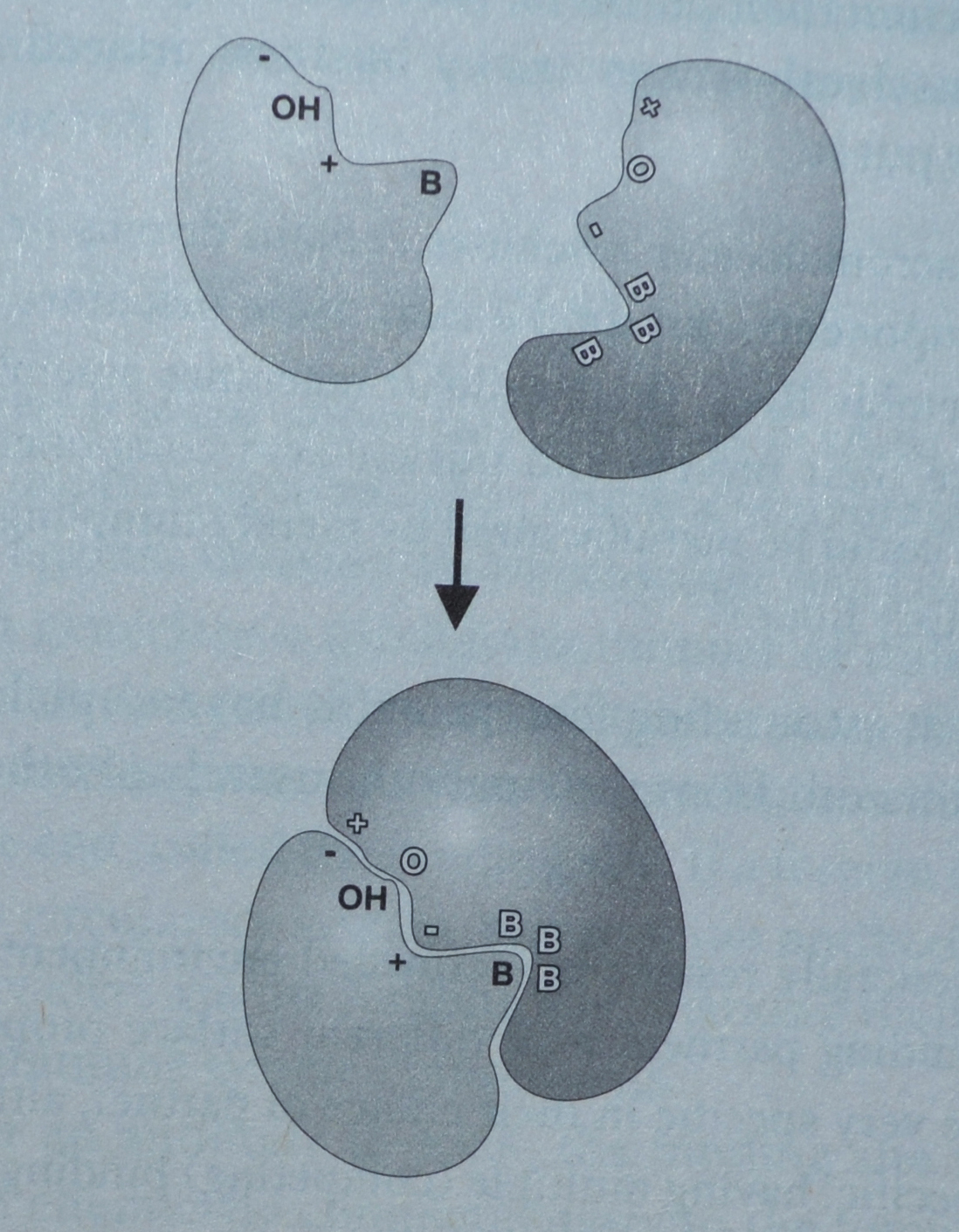 Bilde 3. Et mindre protein som binder seg til et større.
Bilde 3. Et mindre protein som binder seg til et større.
Forklaring til bildet: Både form og kjemiske egenskaper ved proteinoverflatene må være komplementære til hverandre for å knyttes sammen. + står for positiv kjemisk lading og - står for negativ ladde grupper på protein-overflaten. B står for vannavstøtende, olje-grupper. OH og O står for polar-grupper som kan knytte 'hydrogen-bånd' til hverandre.
Å knytte seg til alt
Ved å studere immunsystemet har en lært mye om hvordan proteiner knytter seg til hverandre. Det komplekse immunsystemet hos virveldyr beskytter mot invasjon av mikroskopiske rovdyr. Et aspekt av systemet genererer et forbløffende antall av ulike proteiner, antistoffer, som patruljerer sirkulasjonssystemet. Mye av strukturen deres er lik, men i ene enden, der de binder seg til inntrengere, skiller de seg fra hverandre. Om en fremmed celle eller virus lurer i systemet, er det sannsynlig at en eller flere antistoffer knytter seg til det, som markerer dem for ødeleggelse av andre komponenter i immunsystemet.
For at et antistoff skal binde seg, må tilknytningsstedet være geometriske og kjemisk komplementært til den fremmede overflaten. Før en visste det en vet nå om immunsystemet, trodde man at antistoffer hos virveldyr var formet av naturlig seleksjon til å gjenkjenne overflater av tidligere påtrufne virus, slik at eneste antistoffer tilgjengelige ville være de som 'passet til' tidligere eller nåværende inntrengere. Men påfølgende eksperimenter viste at om forsøksdyr ble injisert med syntetiske kjemikalier som sannsynligvis ikke tidligere hadde eksistert på jorda, fantes det antistoffer som var i stand til å binde seg til det menneskelagde materialet. Det innebar at noen 'bindesteder' (bindingsites) var komplementære til former som dyret eller dets forfedre aldri tidligere hadde møtt. Hvordan kunne det skje?
Mye hardt lab-arbeid viste omsider at tricket med å generere mange ulike antistoffer, fra et lite sett gener, er samme prinsippet som tillater et stort antall av ulike pokerhender å bli delt ut fra samme kortstokk. temet inneholder spesifikt molekylært maskineri som bl.a. skyfler segmenter av gener, som tillater veldig mange antistoffer å bli produsert med en ekstraordinær variasjon av tilknytningssteder.
Form-rommet (Shape-space)
For å forklare anti-stoffenes evne til å gjøre dette, oppfant matematikeren Alan Perelson begrepet 'form-rommet' (shape space).(5) Formrommet visualiserer et slags bibliotek av fysiske objekter, av omtrentlig samme størrelse om et protein-protein-bindingssted. For å vende tilbake til bildet med masse ulike plast-former, så viser det at matchene mellom antistoffene og de syntetiske kjemikaliene ikke ble designet, selv om den forutseende mekanismen som satte immunsystemet i stand til dette, meget sannsynlig var designet. Universet med antistoffer er for alle praktiske formål uendelig. Lik en science-fiction fortelling er objektene i Perelsons protein-rom mangedimensjonale, i den forstand at det har flere enn de vanlige 3 dimensjoner i vår verden. De har også dimensjoner som tar i betraktning deres varierende kjemiske egenskaper, type ladning, olje-områder/vann-avstøtning etc. De ekstra dimensjonene kan tenkes å gjøre rede for plassering og orientering av magneter med ulike poler stikkende utover. Dermed blir det ikke bare form, men også evne til å knytte seg til hverandre.
Anta at tusener av objekter fra form-rom biblioteket er plassert i et godt opprørt svømmebasseng, og et hovedmål for hver enkelt er å finne sin ideelle match. La oss først se på objekter som ukritisk binder seg til hverandre. Anta at noen form-rom objekter ikke var spesielt rigide: De hadde fleksible blekksprut-armer med magneter, som tillot dem å knytte seg til mange andre objekter i svømmebassenget. Selv om de bandt seg sterkt, ville slike objekter som bandt seg til alt, tilkludre prosessen. Ikke spesifikk aggregering er nesten alltid ødeleggende for cellen. Den kan ikke tolerere objekter som binder seg tilfeldig, (6) og de må elimineres. Så kan en tenke seg et par objekter som har komplementære former, men ikke har magneter i rette posisjoner. Selv om en kunne få noen magneter til å dreie rundt, ville det ikke være tilstrekkelig slik at objektene driftet fra hverandre igjen. Lærdommen er: i) ikke-spesifikke blekksprut-objekter som knytter seg sterkt til mange andre objekter er hasardiøse og må fjernes. ii) For å henge spesifikt og godt, må to rigide objekter passe hverandre både i form og magnet-mønster.
 Binding trenger ikke være 'helt eller ingenting'. Et par rigide objekter kan ha former som er temmelig komplementære og magneter som er ganske godt motsvarende. De kan henge ganske godt, men av og til kan en sterk strøm i bassenget eller uvanlig store kollisjoner få dem til å drifte fra hverandre. På den annen side kan et annet par objekter passe sammen som hånd i hanske, med alle magneter perfekt motsvarende hverandre. De kan henge så godt at de sjelden faller fra hverandre, og tilbringer omtrent 99% av tiden i sammen.
Binding trenger ikke være 'helt eller ingenting'. Et par rigide objekter kan ha former som er temmelig komplementære og magneter som er ganske godt motsvarende. De kan henge ganske godt, men av og til kan en sterk strøm i bassenget eller uvanlig store kollisjoner få dem til å drifte fra hverandre. På den annen side kan et annet par objekter passe sammen som hånd i hanske, med alle magneter perfekt motsvarende hverandre. De kan henge så godt at de sjelden faller fra hverandre, og tilbringer omtrent 99% av tiden i sammen.
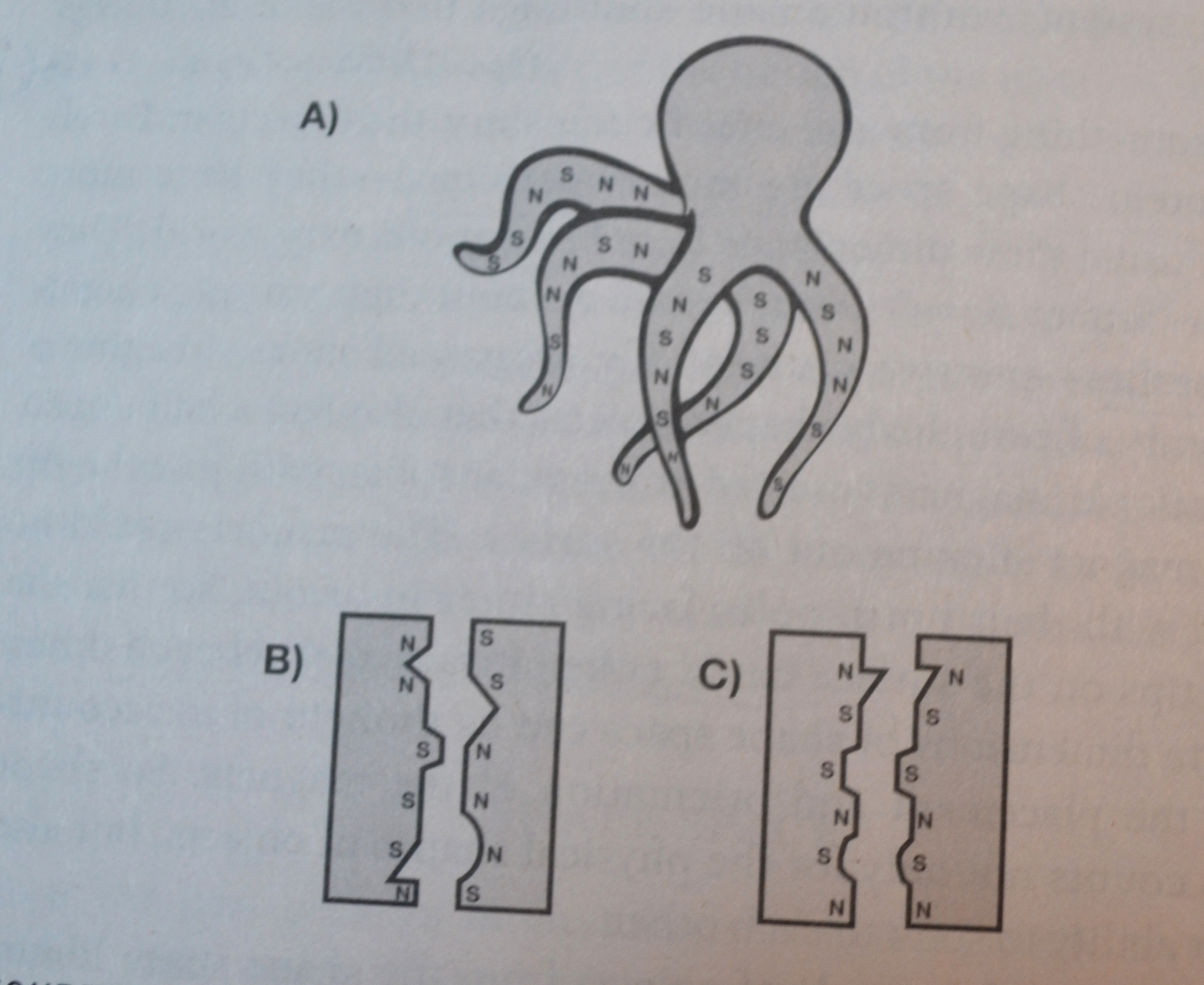
Bilde 4. Tegning med objekter fra form-rom bibliotek.
Forklaring til bildet: N står for nord, og S for Sør-pol på magnet. A) Den flagrende blekksprut-lignende formen ville knytte seg ikke-spesifikt til mange objekter. B) Disse rigide objektene er komplementære i magnetisme, men ikke i form, så de ville ikke knytte seg særlig godt til hverandre. C) Disse rigide objektene er komplementære i form, men ikke i ladning, så de ville heller ikke knytte seg særlig godt til hverandre.
(Fra 'The Evolution Revolution' Kap. 1-slutten -av Dr. Lee M. Spetner, Jerusalem, Israel, Juni 2014: Under spesielle forhold, så kan en tilstrekkelig høy mutasjonsrate sammen med seleksjon, bygge informasjon. Et eks. er dannelse av antistoffer i virveldyrs immun-system. Men disse mutasjoner er av somatisk type, som innebærer at de ikke dukker opp i forplantningen. Dermed utsettes det ikke for seleksjon. Under spesielle forhold kan mutasjonsrate være så høy som 1 promille pr. base pr. generasjon (McKean et al. 1984), som er 1 million gang høyere enn gjennomsnittlig mutasjonsrate i befolkningen. Men det gjelder bare beta-lymfocyter og bare spesielt begrenset sted i genomet, når det er under angrep av giftige stoffer. En høy mutasjonsrate kan også gjelde dubletter og tripletter, noe som gjør seleksjon mulig. Men som nevnt: Om slike høye mutasjonsrater skulle inntreffe i kjønnscellene i stedet for beta-lymfocytene så ville arten dø ut)
 Bilde 5. Ironisk bibliotek-humor (brukt med tillatelse)
Bilde 5. Ironisk bibliotek-humor (brukt med tillatelse)
Hvor stort er form-rommet?
Vi kan tilpasse lærdommer fra immunsystemet og 'form-rommet' for å hjelpe å forstå problemet som tilfeldige mutasjoner ville møte i å lage nye steder hvor proteiner kunne bindes sammen i cellen. Immunforsvaret er satt sammen for å omgå problemet. Men hva skjer om en fjerner 'fabrikanten' som frambragte alle de nevnte plastikkbitene i bassenget? Eksperimenter med lignende system i laboratorier har satt vitenskapsmenn i stand til å teste endelige subsett av det uendelige utvalget vi nevnte forut, i den hensikt å se hvor stort det må være for å takle spesielle utfordringer. Disse eksperimentene gjelder proteinbindinger generelt, ikke bare knyttet til immunsystemet. En stor hindring i forhold til neo-darwinistisk evolusjon er følgende: De fleste proteiner i cellen opererer som komplekse sammensetninger på et halvt dusin eller flere proteiner i kjeder. (7) Hemoglobin omfatter en sammensetning av to slag av aminosyre-kjeder. Så om ikke de sammensetningene var sammen fra starten, så måtte separate proteiner en gang i fortiden utvikle evnen til å binde seg til hverandre. Men det ville vært en risiko-business. Vi har nevnt problemet med om et protein utviklet en overflate som bandt seg vilkårlig til andre proteiner, lik 'blekksprut-formen' i A. Det ville knytte den til mange andre proteiner og ødelegge selektiv parsammenkobling i cellen. Så ville en ha mange protein-par som tilnærmet ikke ville knytte seg til hverandre i det hele, slik vi nevnte for B og C i bilde 4.
Eksperimenter tok utgangspunkt i et 'bibliotek' av størrelsesorden hundre millioner former. De brukte ulike molekyler, f.eks. et annet protein som agn, og forsøkte å trekke opp fra miksturen av antistoffer, ett som ville knytte seg til agnet. De fant i korthet noe som kunne binde seg til proteinet med moderat styrke. (8) I årenes løp så økte de størrelsen av antistoff biblioteket fra 100 millioner til 100 milliarder og mer. De fant at styrken på bindinger økte med antall antistoffer, liksom forventet. (9) I alle disse eksperimentene ble mutasjoner bevisst holdt nær til en koherent kobling av aminosyrer, som var nær hverandre for å få så mange nye bindingssteder som mulig. Om ikke laborantene bevisst hadde styrt endringene til et koherent protein-område, så ville mesteparten ha blitt spredt, ute av stand til effektivt å interagere. I det tilfellet måtte i gjennomsnitt et meget større antall mutasjoner ha blitt separert ut, for å finne én som ville binde spesifikt til mål-proteinet.
Tapt i form-rommet
For cellulære proteiner er det, i motsetning til hos anti-stoffer, ingen innebygd mekanisme for å lage nye bindings-forekomster. Cellulære proteiner er nesten alltid laget med bare én sekvens, ikke milliarder av ulike sekvenser, som i antistoffer. Den eneste måte å få en ny sekvens for et cellulært protein, er mange generasjoner av tilfeldige mutasjoner. Dette er spesielt sent og ekstremt ineffektivt. Hvor mye utgjør dette av en hindring for neo-darwinistisk evolusjon. Sett hypotetisk at en gitt organisme skulle gis en fordel ved at spesielt to av dens proteiner som hadde virket hver for seg, skulle binde seg til hverandre. Kanskje det nye protein-komplekset kunne utføre en ny oppgave eller en gammel en bedre? Lærdommen fra form-rommet er at vi måtte leter gjennom titalls millioner av ulike mutasjons-sekvenser, før vi tilfeldigvis slumpet på én som kunne binde med moderat styrke, ca. halvparten av tiden. Det er formodentlig minimum for å få noen biologisk effekt av endringen. (11) Siden mutasjonsraten er så lav, ca. én til ti- hundre millioner, så måtte en lete hardt over et enormt antall organismer før en støtte borti den heldige.
hundre millioner, så måtte en lete hardt over et enormt antall organismer før en støtte borti den heldige.
Bilde 6. Når en ikke finner fram i rommet
Den enkleste måten å endre et protein er ved punktmutasjon, der én aminosyre blir erstattet med en annen i en posisjon i proteinet. Det er 20 ulike aminosyrer i proteiner. Det innebærer at om bare 5-6 posisjoner endret til de rette, de som tillot proteinet å binde, så ville det være en begivenhet med omtrent den rette frekvens. 20 multiplisert med seg selv 5 ganger gir 3 millioner og 20 multiplisert med seg selv 6 ganger gir 60 millioner, nær innpå de 10-100 millioner ulike som vi trengte. 5-6 mutasjoner synes ikke særlig mye, når proteiner består av hundrevis av aminosyrer, men det er et viktig poeng at det kreves 5-6 samsvarende (koherente) mutasjoner, bare for å få to proteiner til å binde seg til hverandre. Ett manglende steg viser seg å være mye vanskeligere når stegene skal være kontinuerlige. Om multiple steg mangler, blir vanskegraden økt eksponentielt. Så kan vi i raushetens navn si at omtrent en tredel endringer i aminosyrer, er nøytrale. Da gjenstår 3-4 samsvarende aminosyre-endringer, som kan volde problemer om de skjer hver for seg. Tre eller fire samtidige aminosyre-endringer er som å droppe flere trappetrinn i en evolusjonær trapp. Det er 1-2 flere aminosyre-endringer enn det som trengtes for å oppnå klorokin- resistens -med kallenavn CCC (chloroquine-complexity-cluster) i malaria, noe som har sannsynlighet 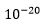 ved fødsel. M.a.o. blir det å generere én ny cellulær protein-protein binding minst av samme vanskegrad som utvikling av klorokin-resistens i malaria-parasitten.
ved fødsel. M.a.o. blir det å generere én ny cellulær protein-protein binding minst av samme vanskegrad som utvikling av klorokin-resistens i malaria-parasitten.
Anta nå at for å oppnå en fordelaktig egenskap, så måtte en ha ikke bare én, men to ny protein-bindinger. Som nevnt var sannsynligheten for CCC 1: 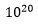 - siste tall tilsvarer hundre milliarder, milliarder organismer: flere enn antall pattedyr som har eksistert på jorda. Under ellers like forhold, ville sannsynligheten for å oppnå en dobbel CCC -kvadratet av én CCC, eller 1:
- siste tall tilsvarer hundre milliarder, milliarder organismer: flere enn antall pattedyr som har eksistert på jorda. Under ellers like forhold, ville sannsynligheten for å oppnå en dobbel CCC -kvadratet av én CCC, eller 1: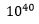 . Det siste tallet er et høyere tall enn antall celler det sannsynligvis noensinne har eksistert på jorda. Statistikk dreier seg mye om gjennomsnitt, så en kan ikke hevde at det er logisk umulig, men det ville ikke være å forvente to slike protein-bindinger etter neo-darwinistiske mekanismer i løpet av jordas historie. På kortform er komplekser av tre-fire proteiner utenom rekkevidden til ikke-styrte neo-darwinistiske mutasjoner. De går tapt i form-rommet. Og den store majoriteten av proteiner i celler samarbeider i komplekse sammenkoblinger på seks proteiner eller flere. Langt utenom rekkevidden til ikke-styrte neo-darwinistiske mutasjoner.
. Det siste tallet er et høyere tall enn antall celler det sannsynligvis noensinne har eksistert på jorda. Statistikk dreier seg mye om gjennomsnitt, så en kan ikke hevde at det er logisk umulig, men det ville ikke være å forvente to slike protein-bindinger etter neo-darwinistiske mekanismer i løpet av jordas historie. På kortform er komplekser av tre-fire proteiner utenom rekkevidden til ikke-styrte neo-darwinistiske mutasjoner. De går tapt i form-rommet. Og den store majoriteten av proteiner i celler samarbeider i komplekse sammenkoblinger på seks proteiner eller flere. Langt utenom rekkevidden til ikke-styrte neo-darwinistiske mutasjoner.
Bilde 7. Resistens i malaria-parasitten
Oversettelse samt utvalg av stoff og bilder ved Asbjørn E. Lund
 I boka 'The Edge of Evolution' (2007) bedømmer M. Behe massive empiriske data, knyttet til tre viktige medisinske mikroorganismer (AIDS-virus, malaria-viruset og E-coli bakterien). Disse mikroorganismene er kjent for å være meget muterbare og gjennomgå massive seleksjons-sykluser. De blir referert til som 'kraftfulle eksempler på evolusjonære systemer'. Behe viser at mens disse organismene raskt tilpasser seg nye eksterne omgivelser, så frambringer de ingen indre funksjonelle endringer. Selv innen disse 'ideelle evolusjonære systemene', så representerer type endring bare 'fine-tuning', ikke sanne nyskapninger. Selv om forskere har fulgt disse organismene gjennom et enormt antall reproduktive sykluser, mange flere enn det høyere organismer har gjennomlevd på jorda, så har alle observerte endringer bare vært midlertidige virkemidler. Behe viser klart at det primære aksiomet ikke kan skape ikke-reduserbar kompleksitet, selv på enkleste nivå.
I boka 'The Edge of Evolution' (2007) bedømmer M. Behe massive empiriske data, knyttet til tre viktige medisinske mikroorganismer (AIDS-virus, malaria-viruset og E-coli bakterien). Disse mikroorganismene er kjent for å være meget muterbare og gjennomgå massive seleksjons-sykluser. De blir referert til som 'kraftfulle eksempler på evolusjonære systemer'. Behe viser at mens disse organismene raskt tilpasser seg nye eksterne omgivelser, så frambringer de ingen indre funksjonelle endringer. Selv innen disse 'ideelle evolusjonære systemene', så representerer type endring bare 'fine-tuning', ikke sanne nyskapninger. Selv om forskere har fulgt disse organismene gjennom et enormt antall reproduktive sykluser, mange flere enn det høyere organismer har gjennomlevd på jorda, så har alle observerte endringer bare vært midlertidige virkemidler. Behe viser klart at det primære aksiomet ikke kan skape ikke-reduserbar kompleksitet, selv på enkleste nivå. I boka Darwins Black Box forklarte Michael Behe hvordan design kan forståes i forbindelse med arrangering av deler. Det kan også oppdages i forbindelse med tilpasning av komplekse deler, selv om grunnen for tilpasningen er utydelig. Om en f.eks. går gjennom en skrapdynge, hvor alle slags komplekse deler ligger rundt omkring. Selv om skrapdynga var fylt av mange tilvirkede deler, var det ikke grunn til å tro at de hadde noe med hverandre å gjøre. Men anta at du så en kompakt delehaug, og da du plukket opp en del -så fulgte resten av delene med den. Selv om en ikke visste funksjonen til den sammensatte delen, så ville en være ganske sikker at den hadde blitt satt sammen med hensikt, fordi de passet spesifikt sammen.
I boka Darwins Black Box forklarte Michael Behe hvordan design kan forståes i forbindelse med arrangering av deler. Det kan også oppdages i forbindelse med tilpasning av komplekse deler, selv om grunnen for tilpasningen er utydelig. Om en f.eks. går gjennom en skrapdynge, hvor alle slags komplekse deler ligger rundt omkring. Selv om skrapdynga var fylt av mange tilvirkede deler, var det ikke grunn til å tro at de hadde noe med hverandre å gjøre. Men anta at du så en kompakt delehaug, og da du plukket opp en del -så fulgte resten av delene med den. Selv om en ikke visste funksjonen til den sammensatte delen, så ville en være ganske sikker at den hadde blitt satt sammen med hensikt, fordi de passet spesifikt sammen.  Bilde 3. Et mindre protein som binder seg til et større.
Bilde 3. Et mindre protein som binder seg til et større. Binding trenger ikke være 'helt eller ingenting'. Et par rigide objekter kan ha former som er temmelig komplementære og magneter som er ganske godt motsvarende. De kan henge ganske godt, men av og til kan en sterk strøm i bassenget eller uvanlig store kollisjoner få dem til å drifte fra hverandre. På den annen side kan et annet par objekter passe sammen som hånd i hanske, med alle magneter perfekt motsvarende hverandre. De kan henge så godt at de sjelden faller fra hverandre, og tilbringer omtrent 99% av tiden i sammen.
Binding trenger ikke være 'helt eller ingenting'. Et par rigide objekter kan ha former som er temmelig komplementære og magneter som er ganske godt motsvarende. De kan henge ganske godt, men av og til kan en sterk strøm i bassenget eller uvanlig store kollisjoner få dem til å drifte fra hverandre. På den annen side kan et annet par objekter passe sammen som hånd i hanske, med alle magneter perfekt motsvarende hverandre. De kan henge så godt at de sjelden faller fra hverandre, og tilbringer omtrent 99% av tiden i sammen. Bilde 5. Ironisk bibliotek-humor (brukt med tillatelse)
Bilde 5. Ironisk bibliotek-humor (brukt med tillatelse) hundre millioner, så måtte en lete hardt over et enormt antall organismer før en støtte borti den heldige.
hundre millioner, så måtte en lete hardt over et enormt antall organismer før en støtte borti den heldige.