Tjue år med "Revolusjonerende" maskiner: Tilfellet med ATP Syntase
 Evolutionnews; 1. november 2016
Evolutionnews; 1. november 2016
Oversatt herfra;
Det var en Eureka! øyeblikk. Da Michael Behe så diagrammet av et bakterielt flagellum i sin biokjemi lærebok, sier han: "Det er en påhengsmotor! Det er designet. Det er ingen tilfeldig sammensetning av deler. "Tusenvis av andre studenter må ha ignorert det åpenbare, eller ellers ydmykt akseptert hva deres professorer fortalte dem, at det naturlige valget var i stand til å skape slike ting. Men Dr. Behe har i følge ham selv et trassig trekk, som ikke ville tolerere simplistiske svar. Fra slike egenskaper ble en revolusjonær født -video. I år har vi feiret det 20. året siden han publiserte 'Darwins Black Box, boken som først satte intelligent design på kartet.
Bilde 1. Roterende energi-motor
For tjue år siden var en annen roterende motor som kom til å gi sine oppdagere 1997-Nobelprisen i kjemi. ATP-syntase var tidligere kjent ved sin kjemiske funksjon, men virkemåten var en svart boks. Da Paul Boyer og John E. Walker åpnet boksen og så en roterende motor på en tiendedel av størrelsen til bakterielt flagellum, ble de forbauset. I årene siden har flere detaljer kommet for dagen. Det er vanskelig å finne noen artikkel som beskriver denne maskinen, som ikke kaller den oppdaget "fantastisk" eller "bemerkelsesverdig." (Leserne kan ønske å se vår animasjon av ATP-syntase, ovenfor.) Og som Behe oppdaget ved å undersøke flagellen, prøver nesten ingen å forklare hvordan den kunne ha blitt til ved neo-darwinistiske prosesser.
 John Walker har fortsatt forskning på denne molekylære motoren siden han fikk Nobel-prisen. Nå i alder av 75, må han være tilfreds med at alle delene er blitt beskrevet, selv om detaljer om utvinning av dreiemoment fra en strøm av protoner fortsatt gjenstår å bli forstått. Hans nyeste artikkel, som nettopp ble publisert av Proceedings of the National Academy of Sciences (PNAS) med tre kolleger fra Cambridge, viser at overraskelsene fortsetter å komme.
John Walker har fortsatt forskning på denne molekylære motoren siden han fikk Nobel-prisen. Nå i alder av 75, må han være tilfreds med at alle delene er blitt beskrevet, selv om detaljer om utvinning av dreiemoment fra en strøm av protoner fortsatt gjenstår å bli forstått. Hans nyeste artikkel, som nettopp ble publisert av Proceedings of the National Academy of Sciences (PNAS) med tre kolleger fra Cambridge, viser at overraskelsene fortsetter å komme.
Levende celler trenger brensel i form av adenosintrifosfat, eller ATP, for å holde seg i live. Dette drivstoffet genereres av en molekylær maskin laget av to motorer forbundet med en rotor. Én genererer rotasjon ved å bruke energi som tilveiebringes ved oksidativ metabolisme eller fotosyntese; Den andre bruker energi som overføres av rotoren for å lage ATP-molekyler fra dens byggeklosser, adenosindifosfat eller ADP og uorganisk fosfat. Strukturen har blitt bestemt av en 'sopp' , isolert fra dens cellulære kraftverk, mitokondriene, der maskinen opererer. Det gir ubemerkede detaljer om maskinens tegning og hvordan det fungerer. Funksjonsprinsippene til 'sopp-maskinen' gjelder for lignende maskiner i alle arter.
Bilde 2. Kinesin forbruker også ATP
Før nå var bare rundt 85 prosent av strukturen bestemt. De siste 15 prosent var skjult inne i membranen som forankrer maskinen. Ved å utvinne arbeidsmotorer fra en sopp og kombinere den med motparter fra en ku's mitokondrielle versjon, var teamet Vinothkumar, Montgomery, Liu og Walker i stand til å se på maskinen med enestående klarhet:
"Som beskrevet her av cryo-EM, har vi bestemt strukturen til hele det monomere F-ATPase-komplekset fra mitokondrierene til den moderat termofile soppen, Pichia angusta , bundet til den inhibitoriske regionen av det naturlig tilknyttede inhibitorproteinet, IF1 (inhibitor av F1 -ATPase). Denne strukturen fyller betydelige hull i vår kunnskap om mekanismen til F-ATPasen. For det første bidrar den til vår forståelse av koblingsmekanismen ved å gi uoppdagede detaljer om den perifere stilken og hvordan den er festet til både det katalytiske F1-domenet og membransektoren til enzymet. For det andre gir den en uavhengig beskrivelse av transmembran protonbanen for protoner, som bidrar til både å definere fellesfunksjoner i proton-translokasjonsmekanismen i bakterielle og mitokondrielle F-ATPaser og til å forklare menneskelige patologiske mutasjoner i underenheten."
 Den siste klausulen forsterker Behes konsept om irreduserbar kompleksitet. Mutasjoner ødelegger ting. Hvis en av delene er ødelagt eller mangler, blir folk syke eller dør. Selv om det er variasjoner i ATP-syntase mellom bakterier og eukaryoter, særlig i antall c-underenheter i rotoren, er de fleste deler "høyt konserverte" mellom riker og arter. Forfatterne snakker om deler som er "strengt bevart" eller "helt bevart." Det er så mange viktige deler i denne maskinen, det kan ikke fungere med mindre alt er på plass og matchet for funksjonell samhandling.
Den siste klausulen forsterker Behes konsept om irreduserbar kompleksitet. Mutasjoner ødelegger ting. Hvis en av delene er ødelagt eller mangler, blir folk syke eller dør. Selv om det er variasjoner i ATP-syntase mellom bakterier og eukaryoter, særlig i antall c-underenheter i rotoren, er de fleste deler "høyt konserverte" mellom riker og arter. Forfatterne snakker om deler som er "strengt bevart" eller "helt bevart." Det er så mange viktige deler i denne maskinen, det kan ikke fungere med mindre alt er på plass og matchet for funksjonell samhandling.
Forfatterne bemerker at disse motorene snurrer opp til 350 Hz. Det er en kjappe 21.000 rpm! Tenk på det. Hver rotasjon gir 3 ATP molekyler, som brukes til de fleste energikrevende prosesser i cellen. Hvert trinn til en kinesin-maskin som går ned en mikrotubule -her, hver bevegelse av actin i muskler, forbruker hver fremdrift av en polymerase som oversetter DNA, forbruker ATP. Hvis en ATP-syntasemotor genererer 63.000 ATP-molekyler i ett minutt, forestill deg hvor mange ATP-molekyler som blir dannet av tusenvis av motorene i en enkelt celle. Ikke rart at du kan danne din kroppsvekt i ATP på en eneste travel dag.
Bilde 3. ATP-motoren deler
Vandre bort til en av disse maskinene i tankene dine. Den roterer så fort at det er uskarpt. Den nedre halvdelen spinner som en turbin i et vannkraftverk, ikke drevet av vann, men av protoner. Den øvre halvparten samler ATP i tre par som kontinuerlig kjører "en syklus av substrat-bindende, ATP-formasjon og produkt-fremstilling. Således produserer for hver 360 graders rotasjon -tre molekyler av ATP. "Hvordan kunne forskerne studere noe som beveger seg så fort? De kunne ikke. De måtte bremse den med et "inhibitorprotein" slik at de kunne få en god kikk på det.
De innså at den katalytiske øvre delen rumler. Ved topphastighet genererer konstant innsetting og utstøting av substrater sideveis krefter. Uten en veldig stødig forankring, ville maskinen vibrere seg ut av drift. Og en stødig forankring er akkurat det de fant:
"Selv om de relevante interaksjonene fremdeles ikke er fullstendig løst, viser den nåværende strukturen at vedlegget til det katalytiske domenet er mye mer omfattende og robust enn det hadde vært antatt, som sannsynligvis involverer både de N- og C-terminale domenene til OSCP [oligomycin sensitivitets-tildelende protein] og de N-terminale regioner av alle tre a-underenhetene. Strukturen har også gitt bevis for at den hydrofobe N-terminale regionen av b-underenheten i den nedre enden av den perifere stengelen (distal fra F1-domene), er som forutsagt, foldet inn i to transmembrane a-helikser, bH1 og en del av bH2. Det samhandler med aH1 og aH2, og bH2 med aH5 og aH6, og mest sannsynlig, i tillegg, med sløyfen mellom aH3 og aH4. Den har også bekreftet at midtdelen av periferstengelen, bestående av den sentrale a-spiralformede søylen som er ca. 160 Å lang og levert av bH2, forsterkes av omtrent parallelle a-helikoner fra underenhet d og mest sannsynlig fra underenhet h (som i den relaterte F6). Dermed har den egenskapene til en tilsynelatende stiv og ufleksibel struktur."
Vi inkluderer disse detaljene for å understreke kompleksiteten ved denne maskinen. Uten den robuste statoren og alle dens interaksjoner, kunne maskinen ikke håndtere sideveis krefter i sin høyhastighetsoperasjon.
Men vent; det er mer! Den sentrale stengelen som gir stabilitet, flekser også! Hvorfor?
Video av ATP-virkemåte
"Den andre rollen til den perifere stilken er å bidra til å holde a-underenheten i kontakt med den roterende c-ringen, muligens ved å utøve sidetrykk mot sentralaksen, og dermed sikre integriteten til transmembran proton banen. Underenhet ATP8 kan bidra her via sin C-terminale region. Det er kjent at den lengre C-terminale regionen av relatert ATP8 strekker seg fra membranen inn i perifer stengel, hvor den interagerer med underenheter b og d, hvorved det tilveiebringes en annen avstiver i tillegg til underenhet b for å holde underenhet a mot den roterende c-ringen."
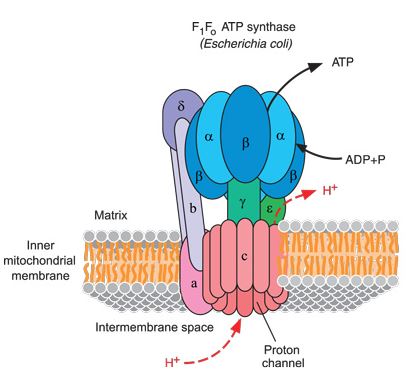 Med andre ord, når protoner går inn i den roterende rotoren på bunnhalvdelen, gir statoren sideveis trykk for å hindre protonene i å lekke ut. Hvor godt utformet må det være?
Med andre ord, når protoner går inn i den roterende rotoren på bunnhalvdelen, gir statoren sideveis trykk for å hindre protonene i å lekke ut. Hvor godt utformet må det være?
Et annet funn vedrører "supernumerære underenheter" uten tilknytning til maskinens katalytiske aktivitet. Noen av disse ser ut til å ha en rolle i å arrangere flere motorer i effektive rader -her,i mitokondriene:
"De supernumerære underenhetene har ingen kjent direkte rolle i ATP-syntesen , men noen av dem formidler interaksjoner mellom monomere F-ATPase-komplekser i dimere [par av motorer] i komplekset som er tilknyttet i rader langs kantene av den mitokondriale tynne veggen."
Forfatterne fant et annet aspekt som utfordrer darwinistisk teori. Ulike versjoner av maskinen fungerer på samme måte til tross for forskjellige aminosyresekvenser (og dermed DNA-koder) for bestemte deler. Dette var uventet, sier de:
"En sammenligning av de nåværende strukturer av bakterielle og mitokondrie- enzymer illustrerer deres kjente likheter i den samlede arkitekturen og i de detaljerte strukturer av de katalytiske og proton-forflyttende regioner. Noe uventet, er perifere stengel-regioner av mitokondrielle og bakterielle enzymer også like, til tross for signifikante forskjeller i underenhet sammensetning og mangel på likhet i sekvens av deres bestanddeler . Dermed har perifere stengler fra bakterier, kloroplaster og eukaryoter lignende konstruksjoner og antagelig liknende fysiske egenskaper, slik at de kan utføre sine roller for å sikre vedlikehold av en intakt protonbane i grensesnittet mellom rotor og stator og for å holde statoren sammen."
Bilde 4. Skjematisk fremstilling: ATP-motoren
Dette betyr at funksjonen er bevart selv når sekvensen ikke er. Hvis naturlig utvalg ikke kunne bygge en irreduserbar kompleks versjon av en maskin, hvor mye mindre kan det bygge flere versjoner?
Hvis det er noe aspekt av naturen som burde vekke vår ærefrykt, bør det være å finne roterende motorer som opererer med flere godt tilpassede deler ved høye hastigheter på utrolig små skalaer. Detaljer om hva Walker team fant kan utforskes i denne åpne artikkelen i PNAS . Det nevner ikke "evolusjon" noe sted, men det nevner design (se ovenfor). Vi håper du vil se på bildene, lese beskrivelsene og legge merke til deres følelsesmessige respons i det de sier, "Strukturen gir mer innsikt i virkemåten til denne fantastiske maskinen."
Se eks. på at mer reklamepenger går til Internett enn TV -her.
Oversettelse og bilder er lagt inn av Asbjørn E. Lund.
 Evolutionnews; 1. november 2016
Evolutionnews; 1. november 2016 Evolutionnews; 1. november 2016
Evolutionnews; 1. november 2016 John Walker har fortsatt forskning på denne molekylære motoren siden han fikk Nobel-prisen. Nå i alder av 75, må han være tilfreds med at alle delene er blitt beskrevet, selv om detaljer om utvinning av dreiemoment fra en strøm av protoner fortsatt gjenstår å bli forstått. Hans nyeste artikkel, som nettopp ble publisert av Proceedings of the National Academy of Sciences (PNAS) med tre kolleger fra Cambridge, viser at overraskelsene fortsetter å komme.
John Walker har fortsatt forskning på denne molekylære motoren siden han fikk Nobel-prisen. Nå i alder av 75, må han være tilfreds med at alle delene er blitt beskrevet, selv om detaljer om utvinning av dreiemoment fra en strøm av protoner fortsatt gjenstår å bli forstått. Hans nyeste artikkel, som nettopp ble publisert av Proceedings of the National Academy of Sciences (PNAS) med tre kolleger fra Cambridge, viser at overraskelsene fortsetter å komme. Den siste klausulen forsterker Behes konsept om irreduserbar kompleksitet. Mutasjoner ødelegger ting. Hvis en av delene er ødelagt eller mangler, blir folk syke eller dør. Selv om det er variasjoner i ATP-syntase mellom bakterier og eukaryoter, særlig i antall c-underenheter i rotoren, er de fleste deler "høyt konserverte" mellom riker og arter. Forfatterne snakker om deler som er "strengt bevart" eller "helt bevart." Det er så mange viktige deler i denne maskinen, det kan ikke fungere med mindre alt er på plass og matchet for funksjonell samhandling.
Den siste klausulen forsterker Behes konsept om irreduserbar kompleksitet. Mutasjoner ødelegger ting. Hvis en av delene er ødelagt eller mangler, blir folk syke eller dør. Selv om det er variasjoner i ATP-syntase mellom bakterier og eukaryoter, særlig i antall c-underenheter i rotoren, er de fleste deler "høyt konserverte" mellom riker og arter. Forfatterne snakker om deler som er "strengt bevart" eller "helt bevart." Det er så mange viktige deler i denne maskinen, det kan ikke fungere med mindre alt er på plass og matchet for funksjonell samhandling. Med andre ord, når protoner går inn i den roterende rotoren på bunnhalvdelen, gir statoren sideveis trykk for å hindre protonene i å lekke ut. Hvor godt utformet må det være?
Med andre ord, når protoner går inn i den roterende rotoren på bunnhalvdelen, gir statoren sideveis trykk for å hindre protonene i å lekke ut. Hvor godt utformet må det være?