En ny hypotese for livets utvikling
(fritt oversatt etter boka: 'Not By Chance' av Dr. Lee Spetner kap. 8; Judaica Press, 1999)
Tilfeldighet er et essensielt trekk i NDT. Det er ingen kjent fysisk eller kjemisk mekanisme for å generere arvelige variasjoner, som vil bedre tilpasningen eller øke kompleksiteten hos levende organismer. Derfor måtte NDT velge tilfeldighet for å produsere variasjonen de trengte. De håpet på det viset å kunne beskrive en evolusjonær prosess, gjennom retningen som naturlig seleksjon angav, og støtte opp under et naturlig opphav for livets opprinnelse og utvikling. NDT har benektet ikke-tilfeldighet som hovedtrekket ved variasjon. På det punktet skilte de lag fra Darwin. Selv om Darwin først valgte tilfeldighet som eneste bestemmende faktor for variasjon, så avviste han senere den posisjonen. Darwin var underrettet om at det er sannsynlig for selv den mest gunstige tilpasning at den dør ut, før den kan overta populasjonen med naturlig seleksjon (Himmelfarb 1962b, s.321). Darwin sa at variasjon ikke bare var tilfeldighet, men en innebygd tendens til å variere under innflytelse av omgivelsene. Darwin gikk tilbake på å tilordne variasjon til tilfeldighet, og uttalte i sakens anledning: "Jeg har hittil noen ganger snakket som om variasjoner skyldtes tilfeldighet. Dette er selvsagt helt ukorrekt uttrykk, men det tjener til rett og slett å erkjenne vår uvitenhet om årsaken til hver spesifikk variasjon.. variasjon er generelt relatert til livsforholdene, som hver rase har vært utsatt for under flerfoldige generasjoner" (Darwin 1872, s.128). Dette synes ikke helt ulikt EITEH, som vi har stilt opp som hypotese.
Bilde 1. Darwin kunne faktisk skifte mening
Uten tilfeldighet har ikke NDT noen mekanisme å tilby for evolusjon. Naturlig seleksjon alene er kraftløs uten variasjon som råmateriale for evolusjon. Som Samuel Butler har uttalt: "Opprinnelsen til variasjon, hva den enn er, er den eneste sanne 'Artenes Opprinnelse'. Tilfeldige variasjoner kan ikke lede til den type evolusjon neo-Darwinistene søker. I motsetning til NDT, postulerer vi en ikke-tilfeldig variasjon. Den oppfyller ikke den neo-darwinistiske agenda, da den ikke bidrar til en naturlig forklaring på livets opphav. Men det er ingen gjeldende teori som makter det. Om vi ser bort fra Neo-Darwinistisk agenda, ser vi at EITEH kan gjøre rede for observasjoner om evolusjon, bedre enn NDT kan gjøre. Det kan gjøre rede for observasjoner som NDT ikke makter å gjøre rede for. Den kan gjøre rede for omgivelses-styrte mutasjoner, rapportert i bakterier. Den kan bidra til å forklare såkalte 'konvergenser'. Bortsett fra livets opprinnelse, så kan vi få en evolusjonær teori som bedre forklarer det vi faktisk observerer omkring oss i verden, av utvikling og tilpasning til omgivelsene.
 EITEH er en hypotese som forklarer mange observerte fenomen som NDT ikke forklarer. En kan ikke kritisere EITEH fordi den ikke gjør rede for utvikling av livet fra ei enkelt celle. En slik utvikling er verken observert eller skikkelig dokumentert. EITEH gjør rede for det som er dokumentert, og det gjør det på en bedre måte enn NDT. Disse er tilstrekkelige kvalifikasjoner for en teori om evolusjon. I følge EITEH, inntreffer tilpassede endringer i organismer, når omgivelsene trigger eller injiserer en endring i enten feno- eller geno-typen. Den kan gjøre rede for omgivelsesbaserte, tilpassede mutasjoner rapportert i bakterier. Det kan gjøre rede for gjennomgående 'konvergenser' funnet gjennom plante og dyre-rekkene. EITEH lider ikke av motsigelser knyttet til NDT, og gir dermed løfte om å frembringe et mer konsistent bilde av livet.
EITEH er en hypotese som forklarer mange observerte fenomen som NDT ikke forklarer. En kan ikke kritisere EITEH fordi den ikke gjør rede for utvikling av livet fra ei enkelt celle. En slik utvikling er verken observert eller skikkelig dokumentert. EITEH gjør rede for det som er dokumentert, og det gjør det på en bedre måte enn NDT. Disse er tilstrekkelige kvalifikasjoner for en teori om evolusjon. I følge EITEH, inntreffer tilpassede endringer i organismer, når omgivelsene trigger eller injiserer en endring i enten feno- eller geno-typen. Den kan gjøre rede for omgivelsesbaserte, tilpassede mutasjoner rapportert i bakterier. Det kan gjøre rede for gjennomgående 'konvergenser' funnet gjennom plante og dyre-rekkene. EITEH lider ikke av motsigelser knyttet til NDT, og gir dermed løfte om å frembringe et mer konsistent bilde av livet.
Hadde NDT, sammen med en annen teori, vært tilstrekkelige til å forklare en naturlig opprinnelse til enkle celler, så ville vi ha en god naturlig forklaring på livets opprinnelse. I så fall ville en metafysisk forklaring vært overflødig. Da ville NDT ha satt f.eks. Bibelsk syn på livets opprinnelse under stress. Forsvaret kunne i så fall ha antatt én av to hovedalternativer. Det første kunne ganske enkelt ha vært å benekte det vitenskapelige synet som ukorrekt, siden det kommer til feil konklusjon. Selv om denne holdningen synes noe 'lavpannet', så er den robust og har stått sin prøve i det 20. århundre i forhold til universets opprinnelse. Det er under 100 år siden at akseptert vitenskapelig syn var at universet var evig. Dette vitenskapelige synet daterte seg fra Aristoteles, og benektet Bibelens skapelses-syn. Til tross for at all vitenskapelig autoritet hevdet et 'evig univers', så var det stri jødisk/kristen motstand mot dette. Hovedpunktet ved Bibelsk skapelses-tanke, at universet har en begynnelse, er blitt bekreftet ved nylige vitenskapelige oppdagelser, selv om noen kan være uenige om tidsskalaen.
Bilde 2. 'Tilhenger' av EITEH
Det andre alternativet ville vært av apologetisk art, å akseptere teorien, og prøve å få skaperen til å passe i vilkårligheten. Det teorien kaller tilfeldig, kan tilegnes skaperens vilje {tilfeldigheter sees som 'gudfeldigheter'-oversetters anmerkning}. Da ville en gjøre nøyaktig det den skotske presten Henry Drummond latterliggjorde apologetikere for. Han spottet de som 'uopphørlig skannet området til naturvitenskapen og vitenskapslitteratur på leit etter hull, hull som de ville fylle opp med G-d." (Drummond 1894, s.426; Himmelfarb 1962, s.393). Om forsvarere av Bibelsk skapelse hadde inntatt en tilpasset apologetisk holdning mot et evig univers {f.eks. Steady State-teorien, oversetters tilføyelse}, så ville de ha blitt tvunget til å gjøre et ydmykende tilbaketog etter nye funn om at universet ikke alltid har eksistert. Selv om det finnes defensive posisjoner som kreasjonister kan ta mot NDT, så benekter teorien skapelse. EITEH derimot, er i utgangspunktet agnostisk, og utgjør ikke noen motsigelse mot skapelse. EITEH er, som en forklaring på evolusjon, faktisk mulig å slutte til ut fra Bibelske kilder.
Vi skal ta med et par emner til, for å illustrere hva det er snakker om i levende organismer:
Utvikling av embryo
 Embryologer har lenge mistenkt at genomet inneholder ett sett av programmerte instruksjoner, for å utvikle embryoet. Molekylærbiologer finner nå bevis for et slikt program, og de oppdager hvordan det virker. I det celler deler seg, så gror og utvikler embryoet seg. Utviklingsbiologer lærer hvordan enzymer kontrollerer celledeling (Murray og Kirschner 1991). De har funnet at proteiner trigger cellen og forårsaker at den deler seg under embryonisk utvikling (O Farrel et al. 1989). Det eksisterer mange slike triggere, og hver handler på sitt utvalgte stadium. Zygoten lager selv proteinene som trigger de første få celle-delingene. Proteiner som trigger senere delinger, er laget av embryoet. Selv om vi ikke ennå vet hvordan det fungerer, så vet vi at hver trigger handler til planlagt tid -for å få embryoet til å utvikle seg i følge planen.
Embryologer har lenge mistenkt at genomet inneholder ett sett av programmerte instruksjoner, for å utvikle embryoet. Molekylærbiologer finner nå bevis for et slikt program, og de oppdager hvordan det virker. I det celler deler seg, så gror og utvikler embryoet seg. Utviklingsbiologer lærer hvordan enzymer kontrollerer celledeling (Murray og Kirschner 1991). De har funnet at proteiner trigger cellen og forårsaker at den deler seg under embryonisk utvikling (O Farrel et al. 1989). Det eksisterer mange slike triggere, og hver handler på sitt utvalgte stadium. Zygoten lager selv proteinene som trigger de første få celle-delingene. Proteiner som trigger senere delinger, er laget av embryoet. Selv om vi ikke ennå vet hvordan det fungerer, så vet vi at hver trigger handler til planlagt tid -for å få embryoet til å utvikle seg i følge planen.
Øyne som ser, ører som hører, en hjerne som kan tenke og kommandere bevegelsene til komplekse organer: Hvordan kunne alt dette enormt komplekse bli dannet ut fra en enkelt celle? Hva slags program er det som organiserer en slik utvikling? Som vi vet, starter utviklingsprogrammet ved en stadig celledobling. På ett eller annet tidspunkt differensierer cellene, som innebærer at de skifter karakter. Til slutt blir noen av cellene til vev eller organer, mens andre celler blir noe annet. Og det skjer på samme måte, nesten alltid: Hvordan skjer det? Det første spørsmålet er hvordan den encellede zygoten kan gi opphav til ulike celler? Uansett hva slags utviklingsprogram, så kan ikke cellene differensiere, uten at tilsynelatende symmetri blir brutt på ett eller annet tidspunkt. Hvordan skjer det?
Det viser seg faktisk at symmetrien er brutt allerede i zygoten, før den deler seg 1.gangen. Når den deler seg, så er ikke de to cellene perfekt identiske. Likevel vil hver av dem gi opphav til ett komplett individ, slik det skjer med eneggede tvillinger. Celler i zygotens nabolag, som kalles pleie- (nurse) celler, lager proteiner som de overfører inn i zygoten i et ikke-uniformt mønster. Fordi cytoplasmaet i zygoten ikke er homogent, så atskiller cytoplasmaet i de to dattercellene seg fra hverandre. Disse proteinene virker på genomet, og bryter til slutt den genetiske symmetrien. Noen av disse proteinene er undersøkt i bananfluen -Drosophila. Zygoten er funnet å ha en gradient av protein-tetthet langs linjen som som skal bli lengdeakse (A/P-akse) for fluen, fra hode til hale. To proteiner, bcd og nos, har gradienter i motsatte retninger. Et tilpasset utviklingsprogram kan, ved hjelp av disse gradientene, og ved å benytte positiv feedback -se under, produsere differensiering langs lengde-aksen. Det foregår en lignende oppbrekking av symmetri langs mage-til-rygg akse, hvis virkemåte er ukjent {da boka ble skrevet 1998 -oversetters merknad}.
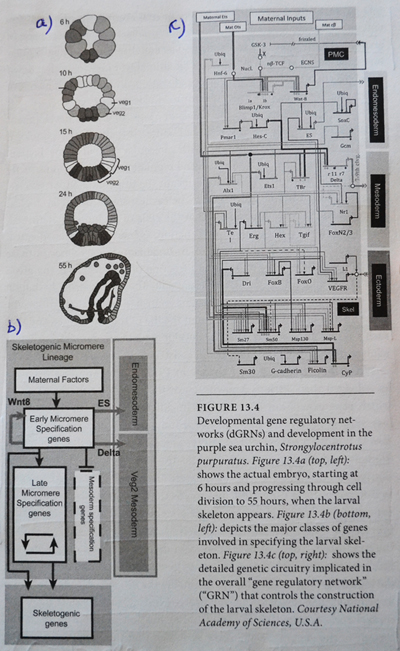
Bilde 3. Eks. på gen-regulerende nettverk (sjøpiggsvin)
I differensieringsprosessen passerer cellen fra en tilstand til en annen ifølge programmet i DNAet. I noen tilfeller avhenger neste tilstand både av nåværende tilstand, og av signaler cellen mottar via naboceller og fra miljøet omkring via budbærer-molekyler. Cellens tilstand bestemmes av hvilke og hvor mye proteiner den tillager (Griffiths et al. 1993). Gjennom proteinene den lager, kan cellen karakteriseres som f.eks. en levercelle, magecelle, hudcelle eller muskelcelle. Gjennom utvikling refererer tilstanden til hver celle, hvilken rolle den spiller på hvert trinn. I den voksne refererer celletilstanden til dens funksjonelle rolle. Spesielt viktig i å bestemme cellens tilstand er proteinene, som utgjør det utviklende embryoets system for informasjons-overføring. Disse proteinene tjener som regulatorer for cellens gener. De tjener som utgående signaler for andre celler, og tjener som reseptorer for innkommende signaler. Signaler en celle mottar tjener til å skru utvalgte gener AV og PÅ.
Differensierings prosessen starter med gradienten til bcd og nos proteiner, som danner det som kalles 'gap genene' i det tidlige embryoet. Gap-genene er ansvarlige for å bestemme antall segmenter i bananflue-embryoet. Disse genene forårsaker i sin tur uttrykk av 'par-regjerende' (pair-rule) gener. Disse genene er ansvarlige for å lage segmentvise par. Så er det segment-polaritets gener, som setter A/P polaritet for segmentene. Gap-genene medfører også hvordan 'homeotiske' gener uttrykkes. Disse kontrollerer identiteten til de individuelle segmentene. Homeotiske gener opererer i komplekser med atskillige gener. I Drosophila er disse genene oppdaget, identifisert og navngitt. Bithorax gen-komplekset f.eks. kontrollerer identiteten til det tredje segmentet i fluens bryst. Antennapedia gen-komplekset kontrollerer identiteten til hodet og brystkasse-segmentene. Mye detaljer er fremdeles ukjent, men vi vet at homeotiske gener koder for proteiner som kan slå andre gener AV og PÅ. Denne evnen setter dem i stand til å utøve en kraftfull kontroll over utviklingsprosessen. Homeotiske gener kan regulere både seg selv og hverandre. Gjennom positiv og negativ feedback forsterker de seg selv, og undertrykker andre. I hver celle kan bare étt homeotisk gen være stabilt uttrykt. Dette trekket forsikrer at segmentene blir stabilt uttrykte.
De homeotiske gener i mange arter er alle funnet å ha i seg en sekvens på 180 nukleotider, som er mye like fra ett gen til ett annet. Denne sekvensen er blitt kalt 'homeobox' etter homeotiske gener, men er også funnet i andre gener. Ett gen som inneholder en homeobox, koder for et regulerende protein (Marx 1988, Robertson 1988, De Robertis et al. 1990). De 180 nukleotidene i homeobox koder ett segment på 60 aminosyre av det proteinet. Dette segmentet av det regulerende proteinet er funnet å binde seg til DNAet til et mål-gen. Molekylærbiologer mistenker at alle dyr og planter har slike homeobokser (Vollbrecht og al. 1991). Embryologer har lenge kjent til at i løpet av embryonalperioden virker noen vev som induktorer på nabovev. Det innebærer at noen vev kan få sine naboceller til å gå fra en tilstand til en annen. Om induktoren er fraværende, vil ikke cellen endre seg til rett tilstand. Vitenskapsfolk har nå funnet noen molekylære meldinger som disse induktorene  sender ut, for at induksjon skal skje.
sender ut, for at induksjon skal skje.
Induksjon av en celle i en fotoreseptor, i øyet på bananflue (Drosophila) er et godt studert eks: Det er 8 celler i fotoreseptoren, R1, R2, .., R8. R8 er tilgrensende til R7 og induserer dens utvikling. Det skjer på flg. måte: Cellen R8 har et gen som kalles 'sjefs-genet'(boss gen), som koder et meldings-protein 'sjefs-proteinet'. Sjefsproteinet sitter på overflaten til R8, der den berører R7. Ved kontaktpunktet på overflaten til R7-cellen, er det et receptor protein, som kalles sju (sev) (etter R7). Sju-proteinet sitter innen membranen til cella, som skal bli R7. Lik Janus har sju-proteinet ett uttrykk utover og et annet innover. Sju-proteinet kalles derfor et transmembran-receptor. Sjefs-proteinet binder seg til sju-proteinet, og er fanget av R7-cella. På innsiden av sju-proteinet, er et aktivt sted for et enzym som kalles tyrosin-kinase (et enzym som katalyserer). Protein-kinase er et enzym som legger til en fosfat-gruppe med atomer (fosfor med oksygen), til et spesielt sted på et mål-enzym. Denne prosessen kalles phosphorylation, fører til aktivering av mål-enzymet. Faktisk kan et enkelt protein-kinase aktivere mange molekyler av mål-enzymet, som resulterer i en forsterkning av signalet. Denne kaskaden av aktivitet induserer videre enzym-aktivitet, som signalerer genendringer som svitsjer R7-cella til en fullverdig R7. Hele denne aktiviteten er et eks. på det vi kan kalle induktiv interaksjon.
Bilde 4. Øyet på bananflue (Drosophila)
Feed-back forhindring
 En måte å gjøre en genetisk tilstand arvelig, er å la genet slå seg PÅ og AV med en låse-anordning. En trigger som slår et gen PÅ kan låse det i tilstanden, dersom genet selv står for produksjonen av kontroll-proteinet som holder den PÅ. Når et slikt gen er slått PÅ, vil det forbli PÅ, selv etter at låsemekanismen er fjernet. En slik såkalt 'låsemekanisme' opererer med positiv feedback. Det mest vanlige er negativ feed-back, som er ideell for å holde et gens aktivitet på et vilkårlig nivå, i forhold til behovet for produktet. Tilstanden til genet under slike forhold, er ikke arvelig. Positiv feedback kan derimot lede til arvelige tilstander. En slik 'låsemekanisme' er et velkjent fenomen, oppdaget i bakterie-infeksjon ved lambda-phage (Herskowitz og Hagen 1980). Elektroniske enheter benytter ofte positiv feedback til å knytte seg til én av to ekstremer (AV/PÅ), ofte kalles de flip-flop. En trigger kan endre tilstanden til en slik bryter. Den nye tilstanden vil låse seg selv på plass, og vare selv etter triggeren blir fjernet. Bare om svitsjen blir påvirket av den motsatte triggeren vil den slå seg tilbake. Den aktive hukommelsen til hver computer benytter positiv feedback. En elektronisk svitsj av dette slaget, vil produsere som sitt output enten 1 eller 0 (strømledende eller ikke-strømledende). Arveligheten vil holde seg på
En måte å gjøre en genetisk tilstand arvelig, er å la genet slå seg PÅ og AV med en låse-anordning. En trigger som slår et gen PÅ kan låse det i tilstanden, dersom genet selv står for produksjonen av kontroll-proteinet som holder den PÅ. Når et slikt gen er slått PÅ, vil det forbli PÅ, selv etter at låsemekanismen er fjernet. En slik såkalt 'låsemekanisme' opererer med positiv feedback. Det mest vanlige er negativ feed-back, som er ideell for å holde et gens aktivitet på et vilkårlig nivå, i forhold til behovet for produktet. Tilstanden til genet under slike forhold, er ikke arvelig. Positiv feedback kan derimot lede til arvelige tilstander. En slik 'låsemekanisme' er et velkjent fenomen, oppdaget i bakterie-infeksjon ved lambda-phage (Herskowitz og Hagen 1980). Elektroniske enheter benytter ofte positiv feedback til å knytte seg til én av to ekstremer (AV/PÅ), ofte kalles de flip-flop. En trigger kan endre tilstanden til en slik bryter. Den nye tilstanden vil låse seg selv på plass, og vare selv etter triggeren blir fjernet. Bare om svitsjen blir påvirket av den motsatte triggeren vil den slå seg tilbake. Den aktive hukommelsen til hver computer benytter positiv feedback. En elektronisk svitsj av dette slaget, vil produsere som sitt output enten 1 eller 0 (strømledende eller ikke-strømledende). Arveligheten vil holde seg på  ubestemt tid, inntil en ny trigger fra en annen omgivelse, kan resette genet.
ubestemt tid, inntil en ny trigger fra en annen omgivelse, kan resette genet.
Bilde 5-venstre. Eks. på feedback-forhindring i biokjemisk prosess Bilde 6-høyre. Gen-svitsj uten signal fra omgivelsene
Arvelige genetiske svitsjer
Det er kjent at gjensidig undertrykkelse av gener forekommer (Weigel og Meyerowitz 1993). Det er en stabil statis, i én av to tilstander. Den vil befinne seg i nåværende tilstand inntil den trigges til å flippe over til den andre tilstanden. I så måte må det forekomme genetiske svitsjer, som fungerer noe á la flipper-spill {kjent fra 1950 tallet i Norge -oversetters kommentar}. Svitsjen omfatter to gener som forsøker å undertrykke hverandre. Bilde 6 viser et par gener (A og B), som er arrangert i form av en binær svitsj i forhold til hverandre. Linjen som kommer opp fra toppen av hvert gen, tilsvarer output og representerer de proteinene som genet forårsaker. Vi kan tenke på dette genet som et kontrollgen for andre gener Disse genene kan kode for en funksjon, likt et sett enzymer som katalyserer en biokjemisk reaksjon. I en flercellet organisme, så kan disse genene slå PÅ et subprogram i utviklingen av embryoet. De to linjene som kommer inn mot genet nedenfra, er dets kontrollsignaler. Signalet som ender i genet via en pil, er en iverksetter (inducer), og den som slutter seg til genet med en liten åpen sirkel, er en repressor. Et signal fra omgivelsene ( ) aktiverer gen A gjennom sitt input-signal, og tilsvarende et signal fra omgivelsene (
) aktiverer gen A gjennom sitt input-signal, og tilsvarende et signal fra omgivelsene ( ) aktiverer gen B. Signalet kan være enten AV(0) eller PÅ (1). Signalene defineres slik at de ikke begge kan være PÅ samtidig, hvilket innebærer at de er gjensidig utelukkende. På Bilde 6, er output fra genet merket 0, hvis genet er AV, og 1 hvis genet er PÅ. Om repressor-input til ett gen er 1, så slås genet AV. Om inducer-signalet er PÅ (1), så overstyrer det repressor signalet og slår genet PÅ. (Induceren fjerner faktisk repressoren fra genets operator-seksjon.) Ett gen på bildet er PÅ, hvis repressoren er 0, eller induceren er 1. Det er AV om repressoren er 1 og induceren er 0. Svitsjen er stabil i én av to posisjoner (bistabil). Én tilstand i systemet er gen A PÅ og gen B AV. Den andre er den motsatte med A AV og B PÅ. Bare ett gen kan være slått PÅ samtidig. I Bilde 6 er A PÅ og B AV.
) aktiverer gen B. Signalet kan være enten AV(0) eller PÅ (1). Signalene defineres slik at de ikke begge kan være PÅ samtidig, hvilket innebærer at de er gjensidig utelukkende. På Bilde 6, er output fra genet merket 0, hvis genet er AV, og 1 hvis genet er PÅ. Om repressor-input til ett gen er 1, så slås genet AV. Om inducer-signalet er PÅ (1), så overstyrer det repressor signalet og slår genet PÅ. (Induceren fjerner faktisk repressoren fra genets operator-seksjon.) Ett gen på bildet er PÅ, hvis repressoren er 0, eller induceren er 1. Det er AV om repressoren er 1 og induceren er 0. Svitsjen er stabil i én av to posisjoner (bistabil). Én tilstand i systemet er gen A PÅ og gen B AV. Den andre er den motsatte med A AV og B PÅ. Bare ett gen kan være slått PÅ samtidig. I Bilde 6 er A PÅ og B AV.
Når ett av genene er PÅ, så aktiverer det ikke bare funksjonen det kontrollerer, det forårsaker også at det produseres ett protein som undertrykker det andre genet. Bilde 6 viser undertrykking av hvert gen, som kommer som output fra det andre genet. Hvert gen forsøker å undertrykke det andre, som indikert av output-linja fra ett gen til repressor av det andre. Hvert av disse repressor-signalene er vist å gå gjennom en 'forsinker' (delay). Disse spiller en rolle bare i overgangsfasen, rett etter genene har endret tilstander. Proteiner i ei celle som har opphørt å være nyttig, forsvinner ikke plutselig. Peptid-bånd, om de får være i fred, kan forbli intakte i måneder eller til og med år. Celler bryter ned deres inaktive proteiner bare når de har grunn til å gjøre det. Og når de gjør det, skjer det på en kontrollert måte (Stryer 1988, s794). Proteinmolekyler forblir intakte, om ikke cellen aktivt bryter dem ned. De forblir i cellen inntil de blir fortynnet gjennom celledeling. Den genetiske svitsj-modellen setter cellen i gang med å degradere ett repressor protein, så snart som genet som styrer produksjonen er slått AV. Forsinkelse i repressorens exit, er representert ved 'FORSINKELSE'-boksene i figurene.
Når ett gen som er PÅ, blir slått AV, slår det av funksjonen det kontrollerer. Genet stopper også å tilvirke repressor-proteinet. Men repressor molekylene som allerede er laget, vil fortsatt være i cellen. Nærvær av begge repressorene vil, isolert sett, beholde begge gener AV, noe som er å regne som en utstabil tilstand. For å vedlikeholde stabilitet i svitsjen, så krever modellen at disse repressor proteinene aktivt skal være slått AV, når begge er nærværende. Nærværet til begge repressorene kan, f.eks. gi et signal til cellen om å starte deaktivering av begge to. Celler er kjent for å ha midlene som strengs for å degradere proteiner selektivt. (Gottesman 1989).
 Input-signaler fra omgivelsene kalles iverksettere (inducers). Dersom
Input-signaler fra omgivelsene kalles iverksettere (inducers). Dersom  er PÅ, så får det gen A til å slås PÅ. Hvis
er PÅ, så får det gen A til å slås PÅ. Hvis  er PÅ, så får det gen B till å slås PÅ. Signalene
er PÅ, så får det gen B till å slås PÅ. Signalene  og
og  utelukker hverandre gjensidig: begge kan ikke være PÅ, men begge kan være AV. Bilde 6 -over, viser en tilstand der begge signaler fra omgivelsene er AV. Tilstanden er stabil fordi output fra A undertrykker B og holder det AV. Gen A er på fordi repressor input er AV (0). Denne tilstanden vil kunne forbli uten signaler fra omgivelsene. Svitsjens tilstand vil oveføres til neste generasjon, og er dermed arvelig, gjennom utallige celledelinger. Repressor proteinet blir delt mellom dattercellene, som vil fortsette å lage det, siden det ikke forekommer noen repressor til gen A. Så lenge A er på, holdes B AV. Gen A vil fortsette å danne repressor-proteiner for gen B, og bygge opp nivået i datterceller som det var i morcellen. Denne prosessen vil fortsette med hver celledeling, og det er dette som gjør tilstanden arvelig. Dette vil fortsette så lenge det ikke kommer nye signaler fra omgivelsene. I Bilde 6 er det ingen signaler fra omgivelsene, som verken er
utelukker hverandre gjensidig: begge kan ikke være PÅ, men begge kan være AV. Bilde 6 -over, viser en tilstand der begge signaler fra omgivelsene er AV. Tilstanden er stabil fordi output fra A undertrykker B og holder det AV. Gen A er på fordi repressor input er AV (0). Denne tilstanden vil kunne forbli uten signaler fra omgivelsene. Svitsjens tilstand vil oveføres til neste generasjon, og er dermed arvelig, gjennom utallige celledelinger. Repressor proteinet blir delt mellom dattercellene, som vil fortsette å lage det, siden det ikke forekommer noen repressor til gen A. Så lenge A er på, holdes B AV. Gen A vil fortsette å danne repressor-proteiner for gen B, og bygge opp nivået i datterceller som det var i morcellen. Denne prosessen vil fortsette med hver celledeling, og det er dette som gjør tilstanden arvelig. Dette vil fortsette så lenge det ikke kommer nye signaler fra omgivelsene. I Bilde 6 er det ingen signaler fra omgivelsene, som verken er  eller
eller  . Det er en nøytral omgivelse, der svitjsen kan være stabil i enhver tilstand.
. Det er en nøytral omgivelse, der svitjsen kan være stabil i enhver tilstand.
Sett nå at omgivelsene endrer seg fra nøytrale, til  , slik at
, slik at  input blir 1, som vist i Bilde 7. Selv om gen B fortsatt har repressor input på 1, så overstyrer iverksetter signalet det, og gen B blir slått PÅ. Når gen B slås PÅ, danner det et repressor-signal for gen A. Gen A slås dermed AV og stopper å lage repressor-signal for gen B. Det som allerede er i cellen, forblir der inntil det blir fortynnet ut av cellen ved celledelinger. Svitsjen har nå flippet over til sin andre stabile tilstand. I denne tilstanden er gen B PÅ, og gen A er AV. Denne tilstanden vil også overleveres til neste generasjon, og være arvelig.
input blir 1, som vist i Bilde 7. Selv om gen B fortsatt har repressor input på 1, så overstyrer iverksetter signalet det, og gen B blir slått PÅ. Når gen B slås PÅ, danner det et repressor-signal for gen A. Gen A slås dermed AV og stopper å lage repressor-signal for gen B. Det som allerede er i cellen, forblir der inntil det blir fortynnet ut av cellen ved celledelinger. Svitsjen har nå flippet over til sin andre stabile tilstand. I denne tilstanden er gen B PÅ, og gen A er AV. Denne tilstanden vil også overleveres til neste generasjon, og være arvelig.
Bilde 7 Gen-svitsj med signal B slått PÅ.
 Anta så at omgivelsene svitsjer tilbake til nøytrale igjen, signalet
Anta så at omgivelsene svitsjer tilbake til nøytrale igjen, signalet  slår seg av til 0 igjen. Det som da skjer, avhenger av hvor lenge gen B har vært slått på. OM gen B har vært PÅ gjennom tilstrekkelige mange celledelinger, til at repressoren laget av A er faset ut, så vil repressoren til B være 0. I det tilfellet vil B fortsette å være på, som vist i Bilde 8. Systemet beholder tilstanden som ble iverksatt da
slår seg av til 0 igjen. Det som da skjer, avhenger av hvor lenge gen B har vært slått på. OM gen B har vært PÅ gjennom tilstrekkelige mange celledelinger, til at repressoren laget av A er faset ut, så vil repressoren til B være 0. I det tilfellet vil B fortsette å være på, som vist i Bilde 8. Systemet beholder tilstanden som ble iverksatt da  ble 1. Denne tilstanden fortsetter i cellen, og arves til senere generasjoner. De nye trekkene som cellene oppnådde da
ble 1. Denne tilstanden fortsetter i cellen, og arves til senere generasjoner. De nye trekkene som cellene oppnådde da  ble 1, overleveres også til senere generasjoner.
ble 1, overleveres også til senere generasjoner.
Bilde 8-venstre. 'B-signal' AV etter å ha vært slått PÅ lenge
Men anta at  bare var på i kort tid. Anta at det gikk tilbake til 0, før repressoren tilvirket av gen A ble faset ut. Da vil vi ha at selv om output fra gen A er 0, så er repressoren til gen B fortatt 1. som vist i Bilde 9. Når
bare var på i kort tid. Anta at det gikk tilbake til 0, før repressoren tilvirket av gen A ble faset ut. Da vil vi ha at selv om output fra gen A er 0, så er repressoren til gen B fortatt 1. som vist i Bilde 9. Når  nå blir 0, så slås gen B AV. Begge gener er AV, og svitsjen er i en ustabil status. Med både A og B AV, blir repressor-degraderende funksjon aktivert, og repressorene til både A og B deaktiveres. Det som så skjer, er avhengig av hvilken av repressorene som først forsvinner. Om omgivelsessignalet
nå blir 0, så slås gen B AV. Begge gener er AV, og svitsjen er i en ustabil status. Med både A og B AV, blir repressor-degraderende funksjon aktivert, og repressorene til både A og B deaktiveres. Det som så skjer, er avhengig av hvilken av repressorene som først forsvinner. Om omgivelsessignalet  var PÅ bare en kort stund, vil ikke endringen det utførte bli overlevert til neste generasjon, og svitsjen vil gå tilbake til sin tidligere tilstand. Om den var på lenge nok, så vil endringen overføres til senere generasjoner.
var PÅ bare en kort stund, vil ikke endringen det utførte bli overlevert til neste generasjon, og svitsjen vil gå tilbake til sin tidligere tilstand. Om den var på lenge nok, så vil endringen overføres til senere generasjoner.
 Bilde 9. 'B-signal' AV etter å ha vært slått PÅ en kort stund
Bilde 9. 'B-signal' AV etter å ha vært slått PÅ en kort stund
Denne modellen forklarer 'dauer effekten' som først rapportert av Victor Jollos. Dauer effekt innebærer langvarige endringer, for å beskrive arvelige endringer som omgivelsene injiserte i tøffeldyr. I modellen med arvelig svitsj, sender omgivelsene et signal til hvert medlem i populasjonen. Signalet aktiverer en genetisk kommando i hvert individ, til å kalle på en forhåndsprogrammert subrutine. Om de nye omgivelsene er kortvarige, vil populasjonen returnere til opprinnelig tilstand. Men om endringen varer lenge nok , så vil populasjonen fortsette i den nye tilstanden, selv om selv om omgivelsene endrer seg igjen. Men selv om tilstanden er arvelig, så er den ikke absolutt. Ett annerledes signal kan få populasjonen til lå endre seg igjen. Men desto lenger omgivelses-signaler varer, desto mer arvelig virker effekten.
Vi har sett at NDT beskriver en 'naturlig', ikke-styrt tilblivelse, og dermed står i motstrid til et skapelsessyn. NDT står også i motstrid med mange vitenskapelige observasjoner. NDT står dermed i veien for en bedre forståelse av bio-vitenskapen og hindrer oss i å gjenkjenne at det kan være metafysiske verdier i universet, som stammer fra en høyere kilde enn mennesket. En Ikke-Tilfeldig Evolusjons Hypotese (EITEH) derimot kan omfavne et skapelsessyn og svarer godt til vitenskapelige observasjoner. {At det så kommer opp spørsmål hvor innebygde muligheter stammer fra, er et spørsmål vitenskapen senere må forholde seg til, men den kan ikke utelukke muligheten av at det er slik i utgangspunktet -oversetters kommentar.}
Stoffutvalg og bilder ved Asbjørn E. Lund {evt. kommentar i klammeparentes}
.
 Vi har sett på noen hovedpunkter omkring Neo-Darwinistisk Teori (NDT) og evolusjon. Vi har etablert En Ikke-Tilfeldig Evolusjons Hypotese (EITEH).
Vi har sett på noen hovedpunkter omkring Neo-Darwinistisk Teori (NDT) og evolusjon. Vi har etablert En Ikke-Tilfeldig Evolusjons Hypotese (EITEH). Vi har sett på noen hovedpunkter omkring Neo-Darwinistisk Teori (NDT) og evolusjon. Vi har etablert En Ikke-Tilfeldig Evolusjons Hypotese (EITEH).
Vi har sett på noen hovedpunkter omkring Neo-Darwinistisk Teori (NDT) og evolusjon. Vi har etablert En Ikke-Tilfeldig Evolusjons Hypotese (EITEH). EITEH er en hypotese som forklarer mange observerte fenomen som NDT ikke forklarer. En kan ikke kritisere EITEH fordi den ikke gjør rede for utvikling av livet fra ei enkelt celle. En slik utvikling er verken observert eller skikkelig dokumentert. EITEH gjør rede for det som er dokumentert, og det gjør det på en bedre måte enn NDT. Disse er tilstrekkelige kvalifikasjoner for en teori om evolusjon. I følge EITEH, inntreffer tilpassede endringer i organismer, når omgivelsene trigger eller injiserer en endring i enten feno- eller geno-typen. Den kan gjøre rede for omgivelsesbaserte, tilpassede mutasjoner rapportert i bakterier. Det kan gjøre rede for gjennomgående 'konvergenser' funnet gjennom plante og dyre-rekkene. EITEH lider ikke av motsigelser knyttet til NDT, og gir dermed løfte om å frembringe et mer konsistent bilde av livet.
EITEH er en hypotese som forklarer mange observerte fenomen som NDT ikke forklarer. En kan ikke kritisere EITEH fordi den ikke gjør rede for utvikling av livet fra ei enkelt celle. En slik utvikling er verken observert eller skikkelig dokumentert. EITEH gjør rede for det som er dokumentert, og det gjør det på en bedre måte enn NDT. Disse er tilstrekkelige kvalifikasjoner for en teori om evolusjon. I følge EITEH, inntreffer tilpassede endringer i organismer, når omgivelsene trigger eller injiserer en endring i enten feno- eller geno-typen. Den kan gjøre rede for omgivelsesbaserte, tilpassede mutasjoner rapportert i bakterier. Det kan gjøre rede for gjennomgående 'konvergenser' funnet gjennom plante og dyre-rekkene. EITEH lider ikke av motsigelser knyttet til NDT, og gir dermed løfte om å frembringe et mer konsistent bilde av livet. Embryologer har lenge mistenkt at genomet inneholder ett sett av programmerte instruksjoner, for å utvikle embryoet. Molekylærbiologer finner nå bevis for et slikt program, og de oppdager hvordan det virker. I det celler deler seg, så gror og utvikler embryoet seg. Utviklingsbiologer lærer hvordan enzymer kontrollerer celledeling (Murray og Kirschner 1991). De har funnet at proteiner trigger cellen og forårsaker at den deler seg under embryonisk utvikling (O Farrel et al. 1989). Det eksisterer mange slike triggere, og hver handler på sitt utvalgte stadium. Zygoten lager selv proteinene som trigger de første få celle-delingene. Proteiner som trigger senere delinger, er laget av embryoet. Selv om vi ikke ennå vet hvordan det fungerer, så vet vi at hver trigger handler til planlagt tid -for å få embryoet til å utvikle seg i følge planen.
Embryologer har lenge mistenkt at genomet inneholder ett sett av programmerte instruksjoner, for å utvikle embryoet. Molekylærbiologer finner nå bevis for et slikt program, og de oppdager hvordan det virker. I det celler deler seg, så gror og utvikler embryoet seg. Utviklingsbiologer lærer hvordan enzymer kontrollerer celledeling (Murray og Kirschner 1991). De har funnet at proteiner trigger cellen og forårsaker at den deler seg under embryonisk utvikling (O Farrel et al. 1989). Det eksisterer mange slike triggere, og hver handler på sitt utvalgte stadium. Zygoten lager selv proteinene som trigger de første få celle-delingene. Proteiner som trigger senere delinger, er laget av embryoet. Selv om vi ikke ennå vet hvordan det fungerer, så vet vi at hver trigger handler til planlagt tid -for å få embryoet til å utvikle seg i følge planen.
 sender ut, for at induksjon skal skje.
sender ut, for at induksjon skal skje. En måte å gjøre en genetisk tilstand arvelig, er å la genet slå seg PÅ og AV med en låse-anordning. En trigger som slår et gen PÅ kan låse det i tilstanden, dersom genet selv står for produksjonen av kontroll-proteinet som holder den PÅ. Når et slikt gen er slått PÅ, vil det forbli PÅ, selv etter at låsemekanismen er fjernet. En slik såkalt 'låsemekanisme' opererer med positiv feedback. Det mest vanlige er negativ feed-back, som er ideell for å holde et gens aktivitet på et vilkårlig nivå, i forhold til behovet for produktet. Tilstanden til genet under slike forhold, er ikke arvelig. Positiv feedback kan derimot lede til arvelige tilstander. En slik 'låsemekanisme' er et velkjent fenomen, oppdaget i bakterie-infeksjon ved lambda-phage (Herskowitz og Hagen 1980). Elektroniske enheter benytter ofte positiv feedback til å knytte seg til én av to ekstremer (AV/PÅ), ofte kalles de flip-flop. En trigger kan endre tilstanden til en slik bryter. Den nye tilstanden vil låse seg selv på plass, og vare selv etter triggeren blir fjernet. Bare om svitsjen blir påvirket av den motsatte triggeren vil den slå seg tilbake. Den aktive hukommelsen til hver computer benytter positiv feedback. En elektronisk svitsj av dette slaget, vil produsere som sitt output enten 1 eller 0 (strømledende eller ikke-strømledende). Arveligheten vil holde seg på
En måte å gjøre en genetisk tilstand arvelig, er å la genet slå seg PÅ og AV med en låse-anordning. En trigger som slår et gen PÅ kan låse det i tilstanden, dersom genet selv står for produksjonen av kontroll-proteinet som holder den PÅ. Når et slikt gen er slått PÅ, vil det forbli PÅ, selv etter at låsemekanismen er fjernet. En slik såkalt 'låsemekanisme' opererer med positiv feedback. Det mest vanlige er negativ feed-back, som er ideell for å holde et gens aktivitet på et vilkårlig nivå, i forhold til behovet for produktet. Tilstanden til genet under slike forhold, er ikke arvelig. Positiv feedback kan derimot lede til arvelige tilstander. En slik 'låsemekanisme' er et velkjent fenomen, oppdaget i bakterie-infeksjon ved lambda-phage (Herskowitz og Hagen 1980). Elektroniske enheter benytter ofte positiv feedback til å knytte seg til én av to ekstremer (AV/PÅ), ofte kalles de flip-flop. En trigger kan endre tilstanden til en slik bryter. Den nye tilstanden vil låse seg selv på plass, og vare selv etter triggeren blir fjernet. Bare om svitsjen blir påvirket av den motsatte triggeren vil den slå seg tilbake. Den aktive hukommelsen til hver computer benytter positiv feedback. En elektronisk svitsj av dette slaget, vil produsere som sitt output enten 1 eller 0 (strømledende eller ikke-strømledende). Arveligheten vil holde seg på  ubestemt tid, inntil en ny trigger fra en annen omgivelse, kan resette genet.
ubestemt tid, inntil en ny trigger fra en annen omgivelse, kan resette genet. Input-signaler fra omgivelsene kalles iverksettere (inducers). Dersom
Input-signaler fra omgivelsene kalles iverksettere (inducers). Dersom  Anta så at omgivelsene svitsjer tilbake til nøytrale igjen, signalet
Anta så at omgivelsene svitsjer tilbake til nøytrale igjen, signalet  Bilde 9. 'B-signal' AV etter å ha vært slått PÅ en kort stund
Bilde 9. 'B-signal' AV etter å ha vært slått PÅ en kort stund